目錄:北京佰司特科技有限責任公司>>細胞/組織/類器官>>類器官培養系統>> HUMIMIC類器官培養系統
| 應用領域 | 環保,食品/農產品,化工,生物產業 |
|---|
仿生微生理系統(類有機體)
類器官串聯芯片培養系統--- HUMIMIC
類器官是指在結構和功能上都類似來源器官或組織的模擬物,通過取特定器官的干細胞(iPS/ES),或者利用人的多能干細胞定向誘導分化,能獲得微型的器官樣的三維培養物,在體外模擬器官發育過程。
類器官芯片培養系統是一種微流控微生理系統平臺,能夠維持和培養微縮的類器官,模擬其各自的全尺寸對應器官的生物學功能和生物的主要特征,如生物流體流動,機械和電耦合,生理組織與流體、組織與組織的比例。
德國TissUse GmbH公司致力于建設"多器官芯片"技術平臺,是*技術前沿的多器官串聯芯片、人體芯片(人體仿生微生理系統)方案的供應商。TissUse GmbH公司創始人,Prof. Dr. med. Uwe Marx教授是德國柏林工業大學醫學生物技術系的榮譽教授,在人體微生理研究領域開創性地提出了多器官芯片系統方案的理論,專注于人體芯片的技術開發,并將該技術轉化為制藥和化妝品行業的決策工具。他提出了人體芯片的概念,即在芯片上生成微縮的、無意識、無感官的人體等效物,即“芯片上的人體human-on-a-chip",并創造性的提出了“類有機體Organismoid"的理論。
Uwe Marx教授分別于 2015 年、2019 年和 2023 年主辦了三次 MPS 業內的CAAT 研討會,并于 2023 年 6 月在柏林主辦了第二屆 MPS 世界峰會。
Uwe Marx教授在德國柏林夏里特大學、萊比錫大學和柏林工業大學工作了35年,期間發表了200多篇行業評審論文和多篇著作。他曾擔任德國政府多項生物技術研究計劃的評審員。Uwe Marx教授始終專注于創新生物制藥產品和技術平臺的發明和實施。免疫毒素、人類單克隆抗體、干細胞移植和 HUMIMIC 多器官芯片平臺都是他研發工作的成果。他于2012年獲得多蘿西-赫加蒂獎(Dorothy Hegarty Award),2014年獲得德國農業和消費者安全部動物保護研究獎(Animal Protection Research Prize),2017年獲得《ALTEX》雜志最佳文章獎(Best Article Award),2021年獲得美國人道協會(The United States of America Humane Society for the Advancement of Replacement, Reduction and Refinement of Animals)羅素與伯奇獎(Russell & Burch Award)。
除學術生涯外,Uwe Marx教授還創辦了多家德國生物技術公司,其中包括ProBioGen、VITA34和TissUse。自 2020 年起,他擔任柏林工業大學分離出的公司 TissUse 的戰略官,負責 HUMIMIC® 技術平臺的商業化。
----------------------------------------------------------------------------------------------------------------------------------------------
體外人體系統有機體生物學的概念在12年前就被提出來,當時被稱為“芯片上的人體human-on-a-chip"或“芯片上的身體body-on-a-chip",從“多器官串聯芯片Multi-Organ-on-Chip"發展而來,將多個類器官串聯起來共培養。
微生理系統MPS成為體外在生物學上可接受的最小尺度模擬人體生理和形態的技術平臺,因此,微生理系統能夠以的精度為每個患者篩選出個性化治療方案。與此同時,第一個人類類器官——干細胞衍生的復雜三維器官模型,可以在體外擴增和自我組織——已經證明,只要給人類干細胞提供相應誘導分化及生長環境,就可以在體外自我組裝成人體類器官。這些早期的類器官可以精確地反映出人體中對應器官的一系列生理狀態和病理特征。我們現在把過去的“芯片上的人體human-on-a-chip"的概念發展成“類有機體Organismoid"的理論。首先,我們提出了“類有機體"的概念,即通過體外的自我組裝的過程,模仿個體從卵細胞到性成熟的發生過程,培養出的——微小的、無思維、無情感的體外的人體等效物。微流控微生理系統(MPS)人體長期類器官培養;(或器官芯片)可以模擬人類生物學,因此,可以對器官的生理功能、器官串擾和藥物的藥理作用進行詳細的時間研究。MPS努力的一個主要目標是概括疾病狀態并研究藥物治療的效果。這些模型有可能改變藥物發現,使新的藥物靶點的有效研究和潛在鑒定,以及在生理學相關模型中對藥物干預進行測試。最近的一些出版物表明,在開發相關的人體模型方面取得了相當大的進展,例如人體單器官肺芯片或肝臟芯片平臺。肺等價物和肝臟等價物的疾病模型的進一步發展正在進行中。然而,人類全身性疾病的進展是通過破壞兩個或多個器官的穩態串擾。為了模擬這種系統相互作用,一些微生理平臺的目標是在不同的培養室中開發不同類器官的芯片上共培養,通過微流體通道相互連接。在多器官芯片(MOC)平臺上成功建立了皮膚活檢組織與三維(3D)人類肝臟球體的器官型穩態長期共培養。隨后,建立基于moc的肝球體與人體三維腸道和神經元組織模型長期共培養,進行全身重復劑量物質測試。
---Marx Uwe
Department of Medical Biotechnology, Institute of Biotechnology, Technische Universit?t Berlin, Berlin, Germany,
TissUse GmbH, Berlin, Germany
An Individual Patient's "Body" on Chips – How Organismoid Theory Can Translate Into Your Personal Precision Therapy Approach. Frontiers in Medicine, 2021, Vol. 8
----------------------------------------------------------------------------------------------------------------------------------------------
微流控微生理系統(MPS)(或器官芯片)是指長期培養人體類器官,可以模擬人類生物學,因此,可以對器官的生理功能、器官之間的交流和藥物的獨理作用進行研究。MPS的一個主要目標是構建疾病模型并研究藥物治療的效果。這些模型可以促進藥物發現,新靶點的有效性研究和功能性鑒定,以及在生理學相關模型中對給藥進行測試。最近的一些文獻證明表明,科學界在開發相關的人體模型方面取得了相當大的進展,例如人體單器官肺芯片或肝臟芯片。肺類器官和肝臟類器官的疾病模型的正在進一步發展中。然而,人類全身性疾病的發生通常是通過兩個或多個器官的穩態交流通訊被破壞。為了模擬這種多器官相互作用的系統性,很多微生理平臺開發了不同類器官在芯片上的共培養,并且通過微流體通道相互連接。在多器官串聯芯片(MOC)平臺上成功建立了人體皮膚活檢組織與三維(3D)人類肝臟類器官的穩態長期共培養。隨后,也建立基于MOC的肝臟類器官、腸道類器官和神經元(腦類器官)長期共培養,進行全身重復劑量物質測試。
---Marx Uwe
Department of Medical Biotechnology, Institute of Biotechnology, Technische Universit?t Berlin, Berlin, Germany,
TissUse GmbH, Berlin, Germany
Functional coupling of human pancreatic islets and liver spheroids on-a-chip: Towards a novel human ex vivo type 2 diabetes model. Scientific Reports, 2017
----------------------------------------------------------------------------------------------------------------------------------------------
德國TissUse的HUMIMIC®類器官串聯芯片培養系統包括控制單元和芯片,控制單元能夠模擬人體內生理環境,包括溫度、壓力、真空度、微流道循環頻率、時間等參數,芯片有不同的微流道設計,針對不同的器官可以單獨設置提供相應的培養條件,提供精準的培養和分化環境。可提供不同類器官的串聯共培養方案,避免單一類器官無法模擬人體復雜生理學條件下器官相互通訊交流的不足。通過類器官模擬人類器官組織的生理發育過程,應用于疾病模型、腫瘤發生、以及藥物安全性、有效性、毒性、ADME等方面的評估,旨在減少和取代實驗室動物測試,簡化人體臨床試驗。
德國TissUse的HUMIMIC®類器官串聯芯片培養系統是通過控制單元來控制微流體環境中的復雜條件,包括物理因素,如溫度(如37°C)、pH值、氧氣和濕度的供應和控制;包括仿生機械學因素,例如:血液或尿液的流動,空氣在肺中的循環,膽汁或胰液的流動,血液和淋巴管的剪切應力,骨骼和軟骨的壓力,皮膚的壓力、肺或胃的外壁,腸的蠕動運動,肌肉收縮等等;包括括神經元和心臟組織的電信號。通過電生理配件實現了在體內模擬組織特異性機電-生化信號的必要功能,能夠為肺、骨和軟骨提供擴張和壓縮力,以及用于肌肉,心臟,腦的電刺激和電信號監測。
德國TissUse的HUMIMIC®類器官串聯芯片培養系統通過一個自動化設備來控制不同的芯片形式。比如HUMIMIC®Chip2芯片,能夠在每個芯片的兩個微流道連接的培養室中培養兩個不同或者相同的器官。芯片上的微泵在每個微流道中產生生理脈動液體循環流動。培養室可以靈活地裝載任何類型的器官,包括基于transwell的培養小室。芯片的底部是光學透明的玻璃,可以實現實時成像。
類器官,具有某一器官多種功能性細胞和組織形態結構的三維(3D)培養物,主要來源于人具有多項分化潛能的多能干細胞(包括人胚胎干細胞和人誘導多能干細胞iPSCs)或成體干細胞。人多能干細胞能分化為個體所有類型的細胞,在體外,經過誘導分化,模擬人體內的器官發育過程,能使人多能干細胞直接分化形成各種類器官;不同組織器官都存在內源組織干細胞,在維持各器官的功能形態發揮著重要作用。這些干細胞在體外一定的誘導條件下,可以自組織形成一個直徑僅為幾毫米的具有組織結構和多種功能細胞的三維培養物。器官芯片是獲取兩個或兩個以上不同的類器官,并且放置在特定的培養芯片上進行共培養,能模擬人體的多個器官參與的生理學過程。


基于這一定義,可以發現類器官具備這樣幾個特征:
? 必須包含一種以上與來源器官相同的細胞類型;
? 應該表現出來源器官的一些功能;
? 細胞的組織方式應當與來源器官相似。

類器官作為一個新興的技術,在科學研究領域潛力巨大,包括發育生物學、疾病病理學、細胞生物學、再生機制、精準醫療以及藥物毒性和藥效試驗。與傳統2D細胞培養模式相比,3D培養的類器官包含多種細胞類型,能夠形成具有功能的“微器官",能更好地用于模擬器官組織的發生過程及生理病理狀態,因而在基礎研究以及臨床診療方面具有廣闊的應用前景。


類器官培養使研究人體發育提供了不受倫理限制的平臺,為藥物篩選提供了新的平臺,也是對現有2D培養方法和動物模型系統的高信息量的互補 。


類器官可以模擬人體的內外環境和人體內的器官,幫助研究人員觀測用藥會對人體內的器官功能產生什么樣的影響。在提倡精準醫學和個體化治療的時代,類器官研究比傳統的二維細胞培養更具有針對性,并且可以區別不同癌癥對于相同藥物的反應。不僅如此,研究者還希望通過誘導多功能干細胞強大的再生潛能,體外生成新的器官或組織,然后移植入體內以替代損壞的組織器官。此外,類器官為獲取更接近自然人體發育細胞用于細胞治療成為可能。通過類器官繁殖的干細胞群取代受損或者患病的組織,類器官提供自體和同種異體細胞療法的可行性,未來這一技術在再生醫學領域也擁有巨大的潛力 。在精準醫學應用中,患者衍生的類器官也被證明為有價值的診斷工具。在進行治療之前,采用從患者樣本來源的類器官篩查患者體外藥物反應,旨在為癌癥和囊胞性纖維癥患者的護理提供指導并預測治療結果。隨著類器官培養系統以及其實驗開發技術的不斷發展,類器官應用到了各大研究領域。
類器官培養的應用案例
類器官的應用舉例---疾病模型
類器官的研究還可用于于疾病模型,如發育相關問題,遺傳疾病,腫瘤癌癥等。
通過使用患者的iPSCs可建立有價值的疾病模型,并能在體外模擬重現病人疾病模型;同時,類器官的建立可以實現對藥物藥效和毒性進行更有效、更真實的檢測。由于類器官可以直接由人類iPSCs直接培養生成,相比于動物模型很大程度上避免了因動物和人類細胞間的差異而導致的檢測結果不一致。


類器官的應用舉例---藥效和毒理測試
可以從患者來源的健康和腫瘤組織樣品中建立類器官。與此同時類器官培養物可用于藥物篩選,這可將腫瘤的遺傳背景與藥物反應相關聯。來自同一患者健康組織的類器官的建立提供了通過篩選選擇性殺死腫瘤細胞而又不損害健康細胞的化合物來開發毒性較小的藥物的機會。自我更新的肝細胞類器官培養物可用于測試潛在新藥的肝毒性(臨床試驗中藥物失敗的原因之一)。在該實施例中,藥物B似乎更適合于治療患者,因為它特異性殺死腫瘤類器官并且不引起肝毒性。


類器官的應用舉例---重演腫瘤形成
類器官的培養和建立,可用于研究腫瘤生成過程中的突變過程,比如說,通過從同一腫瘤的不同區域培養無性繁殖的類細胞器,可以用來研究腫瘤內部的異質性。
來自不同健康器官的類器官的生長,然后對培養物進行全基因組測序,可以分析器官特異性突變譜。通過生長來自同一腫瘤不同區域的類器官,可以用于研究腫瘤內異質性。區域特異性突變譜可以通過類器官的全基因組測序來揭示。使用與上述相似的方法,可以利用類器官來研究特定化合物對健康細胞和腫瘤細胞突變譜的影響。


類器官的應用舉例---腫瘤患者個性化醫療
有助于個性化治療策略的設計,利用病變和正常的類器官來評估各種治療方案。可以篩選多種活性藥物和小化合物,設計更有效的用藥方案。培養成熟的類器官還可以為再生醫學提供廣泛的組織來源。對類器官進行基因操作來修復缺失的功能,并移植回到患者體內。


類器官的應用舉例---類器官“生物Bank"
根據目前的研究進展,建立了活體類器官“生物bank"。其中,腫瘤來源的類器官在表型和基因上都與腫瘤相似。另外,腫瘤類類器官生物庫使生理學相關的藥物篩選成為可能。活體類器官生物庫可用于確定類器官是否對個體患者的藥物反應,具有預測價值。
從結直腸癌患者的健康組織和腫瘤組織中提取的三維有機組織培養物被用于高通量藥物篩選,以確定可能促進個性化治療的基因藥物相關性


類器官培養的報道模型
腸類器官:
HansClever 課題組證實單一的Lgr5 +干細胞能夠在體外持續增殖并自組裝形成隱窩-絨毛樣的小腸上皮結構。進一步的研究結果顯示,單個成人Lgr5 + 干細胞也能在體外成功擴增成結腸類器官,將這種功能性的結腸上皮移植到硫酸葡聚糖誘導的急性結腸炎小鼠模型中可以修復其受損的結腸上皮。這提示利用單一成人結腸干細胞體外擴增進行結腸干細胞治療是可行的。有學者還應用人誘導型多能干細胞( induced pluripotent stem cells,iPSCs) 直接定向分化為小腸組織的方法明確了Wnt3a 蛋白和成纖維細胞生長因子4 是后腸特定分化所必需的物質,而且,這種iPSCs體外構建的人體腸道組織中存在的小腸干細胞,也具有小腸的吸收和分泌功能。這有助于未來人腸道疾病藥物的設計研究,可大大提高了藥物利用率。目前,已有學者構建了小鼠小腸3D 類器官來進行P-糖蛋白抑制劑的篩選,為P-糖蛋白介導的藥物轉運研究提供了強有力的工具。
肝類器官:
2013 年,Takebe 等將人多能干細胞來源的肝細胞、人間充質干細胞和人內皮細胞混合后在基質膠中培養,發現3 種細胞自組裝成3D 化肝芽,將該肝芽移植到丙氧鳥苷誘導肝臟衰亡的TKNOG 小鼠體內后發現這種肝芽可以連接小鼠腸系膜血管,小鼠也出現了人類的藥物代謝過程。這為肝臟器官發生的研究提供了有益嘗試。大型哺乳動物的類器官再造工程也許能加速人類再生醫學研究疾病致病機制研究的進展。2015 年,Nantasanti 等利用狗的肝臟干細胞構建了可分化為功能性肝細胞的肝類器官模型,能用于銅潴留癥的治療。貓被認為是非常適用于研究人類代謝性疾病的模型,所以利用貓的膽道組織構建肝類器官,可能是原發性肝膽疾病研究及藥物篩選的有益工具,但至今也未見利用貓建立長期保持基因穩定的肝臟干/祖細胞培養體系的報道。
胰腺類器官:
有學者發現,當控制骨形態發生蛋白堿性成纖維細胞生長因子、激活素A 和Wnt3a 的表達水平或使用一些小分子化合物進行干預時,可以控制內胚層細胞向特定的方向分化,最終形成胰腺。目前,構建胰島類器官的主要方法包括利用各種干祖細胞產生胰島樣細胞群和利用各種來源的胰腺細胞懸液或胰腺組織塊自組裝成擬胰島體。2011 年,Saito 等將人iPSCs 和胚胎小鼠胰島細胞體外共培養,最后形成能夠產生胰島素的不成熟細胞群,該細胞群由胰島α 細胞包繞中央的β 細胞構成,這種結構和成年鼠胰島相似,將其移植到鏈脲菌素誘導的高血糖小鼠模型中后發現小鼠血糖水平得到極大改善。而進一步的體內實驗研究還需要關注如何規避免疫反應、促進再血管化、促進類器官分化發育等問題,在這方面,Sabek 等提出制備納米腺體來促進胰島發揮作用,這種納米腺體是運用3D 打印技術制作可吸收聚合物膠囊包裹胰島樣細胞團形成的,這可能是未來胰島類器官應用的一種思路。
腦類器官:
近來,譜系重編程技術為獲取特異性種子細胞提供了新的途徑。Lancaster 等通過加入不同生長因子的方法將人類胚胎干細胞( embryonic stem cell,ESC) 和iPSC 在神經培養基3D 培養出了與9 ~ 10周胚胎大腦類似的“類大腦",此類迷你大腦具備人類大腦發育初期的一些主要區域,也出現了背側皮層、腹側前腦等可辨認的特征,但由于缺乏一些特定的特征,如小腦、海馬狀突起等,這些區域無法應用于干細胞模型。之后,該研究者利用小顱畸形患者的皮膚成纖維細胞誘導形成了患者特異性iPSC 細胞系,并應用后者構建了小顱畸形腦類器官模型,通過對照實驗發現,正常ESC和該iPSCs 在類器官形成上并沒有明顯差異,但是后者形成的類器官中有大量未成熟的神經元分化,這為大腦發育紊亂類疾病的研究提供了一定的思路。2015年Kirwan 等應用人iPSC 體外構建了人大腦皮層神經網絡,能夠模擬人體內皮層網絡的發育和功能,這表明可以在體外通過構建大腦類器官來進行人類前腦神經網絡生理學機制的研究。
前列腺類器官:
2014 年,研究人員在實驗室利用來自轉移性前列腺癌患者的活檢標本和去勢抵抗性前列腺癌( castration-resistant prostate cancer,CRPC) 患者的循環腫瘤細胞成功培育出7 個前列腺癌類器官,這些前列腺癌類器官以及從中獲得的腫瘤移植物的組織結構及基因突變譜與患者轉移灶樣本高度相似。Nicholson 等[21]也應用類器官培養技術成功在體外構建患者來源的異種移植物模型,相比于人源性腫瘤組織異種移植及基因工程鼠模型,這種新型的患者來源的類器官能更好地代表CRPC 等高級別前列腺癌,還能代表前列腺癌的龐大臨床疾病譜,而這種疾病譜是目前僅有的前列腺癌細胞系無法代表的,因而在前列腺癌藥物篩選和個體化治療中展現出巨大的應用前景。
類器官串聯培養系統--- HUMIMIC的技術方案:
多器官串聯培養,在缺少病人的情況下測試病人
類器官串聯芯片培養系統技術平臺是一種微流控微生理系統平臺,能夠維持和培養微縮的等效器官,模擬其各自的全尺寸對應器官的生物學功能和生物的主要特征,如生物流體流動,機械和電耦合,生理組織與流體、組織與組織的比率。類器官串聯芯片培養系統包括控制單元,可同時操作多個類器官培養物,能夠模擬人體內生理環境,包括溫度,濕度,氣流,壓力,液體流動等等,芯片底部有不通的微流道設計,針對不同的器官,可以單獨設置提供相應的培養條件,提供精準的培養和分化環境。通過類器官模擬人類器官組織的生理發育過程,應用于疾病模型,如發育相關問題,遺傳疾病,腫瘤癌癥等、以及藥物安全性評價、藥物毒理學鑒定等等研究。


為獲取更高相關與準確的測試結果,我們開發了人體內的器官模型的自動芯片測試:
配備具有指示相關性的器官模型的芯片,以能夠在接觸生物體之前檢測其安全性和有效性;
最終為芯片配備患者自身相關病變器官的亞基,以評估整個個性化治療的效果;
人體生理反應往往涉及更多介質循環和不同組織間相互作用,多器官芯片才能全面反映出機體器官功能的復雜性、完整性以及功能變化,一個相互作用的系統才能更好的模擬整個系統中器官和組織的不同功能。可提供不同類器官的串聯培養解決方案,避免單一類器官培養無法模擬人體內的器官相互通訊關聯的缺陷。把多種不同器官和組織培養在芯片上,然后通過微通道連接起來,集成一個相互作用的系統,從而模擬整個系統中器官和組織的不同功能。
TissUse專有的商用MOC技術支持的器官培養物的數量范圍從單個器官培養到支持復雜器官相互作用研究的器官數量,包括單器官、二器官、三器官和四器官培養的商業化的平臺。成功的案例包括:肝臟、腸、皮膚、血管系統、神經組織、心臟組織、軟骨、胰腺、腎臟、毛囊、肺組織、脂肪組織、腫瘤模型和骨髓以及各自的多器官串聯組合方案。
德國TissUse公司專注于類器官培養系統研究22年,推出的HUMIMIC類器官串聯芯片培養系統,得到FDA的推薦,可提供不同類器官的串聯培養解決方案,避免單一類器官培養無法模擬人體內的器官相互通訊關聯的缺陷,同時也提供相關的技術方案和后續方法試劑支持,屬于國際上少有的“Multi-Organ-Chip" 和“Human-on-a-chip"的方案提供者。


類器官串聯培養系統---HUMIMIC系統
※ 相關組織與液體和組織與組織比率
※ 基于插入的屏障模型的插入培養小室
※ 兼容組織成像
※ 適用于活檢、原代細胞、ipsc衍生的類器官和細胞系
※ 支持多種形狀,如球體,3D屏障,結構化ECM,打印血管支架
一、專業化的硬件
專門設計用于在芯片上進行多重類器官培養的系統。該系統能夠模擬人體內生理環境,包括溫度,濕度,氣流,壓力,液體流動等等,芯片底部有不通的微流道設計,針對不同的器官,可以單獨設置提供相應的培養條件,提供精準的培養和分化環境。能高效均一的獲得用于研究或藥物篩選的類器官,具有較好的重復性。自動化細胞培養、分化一體設備可以高效提高類器官定向分化成功率。包括:自動培養模塊;自動換液模塊(可以執行至少多種不同的培養基/溶液的換液操作)。該系統能同時培養4種不同的類器官,通過微流控聯在一起,進行多器官串聯培養研究。


二、類器官芯片
芯片有不通的微流道設計,針對不同的器官可以單獨設置提供相應的培養條件,提供精準的培養和分化環境;
芯片的泵腔內的柔性膜通過連接的管道,受到壓力或真空的作用,在微流道之中產生脈動體流;
二聯類器官芯片可以在一個芯片上串聯培養2個不同(或相同)的類器官;
三聯類器官芯片可以在一個芯片上串聯培養3個不同的類器官;
四聯類器官芯片可以在一個芯片上串聯培養4個不同的類器官;

三、服務方案



四、器官模型和串聯培養






類器官串聯培養系統---HUMIMIC的應用案例
1、神經球和肝臟的串聯共培養(柏林工業大學)-二聯器官共培養的藥物敏感性
2015, Journal of Biotechnology,
A multi-organ chip co-culture of neurospheres and liver equivalents for long-term substance testing
目前用于藥物開發的體外實驗平臺無法模擬人體內的器官的復雜性,而人類和實驗室動物的系統差異巨大,因此現有的方案都不能準確預測藥物的安全性和有效性。德國、葡萄牙和俄羅斯的研究團隊通過TissUse GmbH公司的微流控多器官芯片(MOC)平臺,測試毒物對多器官的作用,揭示了基于微流控的多器官串聯共培養能夠更好的模擬人體的生理學環境。在體外培養條件下,由于氧氣和營養供應有限,類器官培養往往會隨著時間的推移而去分化。然而微流控系統中通過持續灌注培養基,更好地控制環境條件,如清除分泌物和刺激因子,并且培養基以可控流速通過,以模擬血流產生的生物剪切應力,因此類器官培養物可以保持良好的生長狀態。


雙器官串聯芯片(2-OC)能夠串聯共培養人的神經球(NT2細胞系)和肝臟類器官(肝HepaRG細胞和肝HHSteC細胞)。在持續兩周的實驗中,反復加入神經毒劑2,5-己二酮,引起神經球和肝臟的細胞凋亡。跟單器官培養相比,串聯共培養對毒劑更敏感。因此,多器官串聯共培養在臨床研究中可以更準確地預測藥物的安全性和有效性。推測這是因為一個類器官的凋亡信號導致了第二個類器官對藥物反應的增強,這一推測得到了實驗結果的支持,即串聯共培養的敏感性增加主要發生在較低濃度藥物中。


2、心臟肝臟骨骼皮膚的串聯共培養(哥倫比亞大學)-四聯器官共培養的復雜通訊模型
哥倫比亞大學的科學家也開發了一種多器官串聯芯片,建立了串聯共培養心臟、肝臟、骨骼、皮膚的技術,發表于2022年的Nature Biomedical Engineering,中通過血液循環串聯培養4個類器官,保持了各個類器官的表型,還研究了常見的抗癌藥阿霉素對串聯芯片中的類器官以及血管的影響。結果顯示藥物對串聯共培養類器官的影響與臨床研究結果非常相似,證明了多器官串聯共培養能夠成功的模擬人體中的藥代動力學和藥效學特征。
“值得注意的是,多器官串聯芯片能夠準確的預測出阿霉素的心臟毒性和心肌病,這意味著,臨床醫生可以減少阿霉素的治療劑量,甚至讓患者停止該治療方案。“
Gordana Vunjak-Novakovic, Department of Biomedical Engineering, Columbia University


3、胰島和肝臟在芯片上的串聯共培養(阿斯利康)-二聯器官共培養的反饋通訊
2017, Nature Scientific Reports,
Functional coupling of human pancreatic islets and liver spheroids on-a-chip: Towards a novel human ex vivo type 2 diabetes model
人類系統性疾病的發生過程都是通過破壞兩個或多個器官的自我平衡和相互交流。研究疾病和藥療就需要復雜的多器官平臺作為體外生理模型的工具,以確定新的藥物靶點和治療方法。2型糖尿病(T2DM)的發病率正在不斷上升,并與多器官并發癥相關聯。由于胰島素抵抗,胰島通過增加分泌和增大胰島體積來滿足胰島素不斷增加的需求量。當胰島無法適應機體要求時,血糖水平就會升高,并出現明顯的2型糖尿病。由于胰島素是肝臟代謝的關鍵調節因子,可以將生產葡萄糖的平衡轉變為有利于葡萄糖的儲存,因此胰島素抵抗會導致糖穩態受損,從而導致2型糖尿病。過去已經報道了多種表征T2DM特征的動物模型,但是,從動物實驗進行的研究往臨床上轉化的效果不佳。更重要的是,目前使用的藥物,雖然能緩解糖尿病癥狀,但對疾病進一步發展的治療效果有限。
胰腺和肝臟是參與維持葡萄糖穩態的兩個關鍵器官,為了模擬T2DM,阿斯利康(AstraZeneca)的科學家利用TissUse GmbH公司的微流控多器官芯片(MOC)平臺,通過微流控通道相互連接,建立一個雙器官串聯芯片(2-OC)模型,實現芯片上胰腺和肝臟類器官的串聯共培養,在體外模擬了胰腺和肝臟之間的交流通訊。


建立串聯共培養類器官(胰島+肝臟)和單獨培養類器官(僅胰島或肝臟),在培養基中連續培養15天,串聯共培養顯示出穩定、重復、循環的胰島素水平。而胰島單獨培養的胰島素水平不穩定,從第3天到第15天,降低了49%。胰島與肝球體串聯共培養中,胰島可長期維持葡萄糖水平,刺激胰島素分泌,而單獨培養的胰島,胰島素分泌顯著減少。胰島分泌的胰島素促進了肝球體對葡萄糖的利用,顯示了串聯共培養中類器官之間的功能性交流。在單獨培養中的肝球體中,15天內循環葡萄糖濃度穩定維持在~11 mM。而與胰島共培養時,肝球體的循環葡萄糖在48小時內降低到相當于人正常餐后的水平度,表明胰島類器官分泌的胰島素刺激了肝球體攝取葡萄糖。


4、肺腫瘤和皮膚在芯片上的串聯共培養(拜耳)-抗體藥物對腫瘤和正常器官的影響
針對EGFR抗體的藥物在癌癥治療中被廣泛應用。然而,抗癌藥物的使用量與皮膚不良反應成正比相關,皮膚毒性是上皮生長因子受體(EGFR) 靶向治療中最常見的副作用。但是對于后者的預測目前的方法均無法實現。
雙器官串聯芯片(2-OC)模型,實現芯片上皮膚和腫瘤的共培養,用于模擬重復給藥的劑量實驗,同時還生成安全性和有效性的數據,可以在非常早的階段檢測到西妥昔單抗cetuximab對皮膚的幾個關鍵副作用。這種體外分析能夠在臨床表現之前預評估毒性副作用,可以替代動物試驗,有望成為評價EGFR抗體和其他腫瘤藥物治療指數的理想工具。


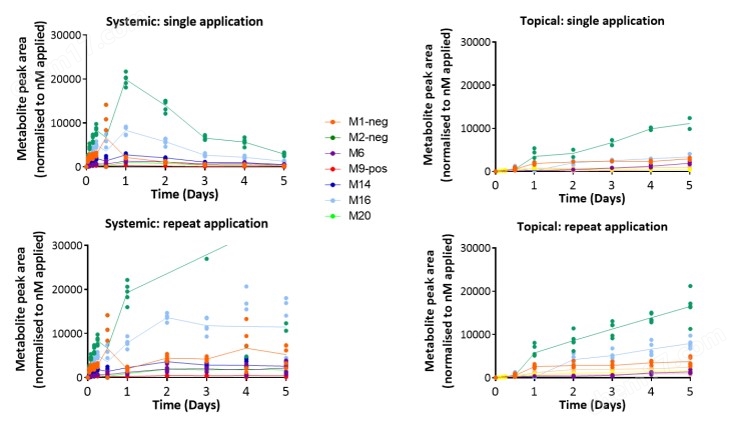
5、皮膚-肝臟在芯片上的串聯共培養(拜爾斯道夫公司)—評估化妝品不同的給藥途徑
一種基于芯片的組織培養平臺已經開發出來,使化妝品和藥物對一套微型人體內的器官的影響測試成為可能。這種“人-片"平臺旨在生成可復制的、高質量的人體物質安全性預測體外數據。被測物質進入表皮或在表皮內代謝,然后泵入肝臟并激活相應的CYPs。因此,在肝臟和皮膚的聯合培養中,多器官芯片是一種有前途的體外方法,用于全身和局部劑量的化妝品和藥物。

皮膚等效物的培養整合在一個系統中。芯片上的微泵使代謝運輸和附加的生理剪切應力成為可能。肝臟和皮膚等效物存活10天,并顯示緊密連接和特異性轉運蛋白的表達。每天服用咖啡KAFEI因、維甲酸和倍他米松-21-戊酸,持續7天,以研究已知可被皮膚和肝臟代謝的化合物的作用。將表面敷于表皮的效果與直接敷于培養基的效果進行比較,分析對皮膚滲透和代謝的影響。對肝臟和皮膚等價物進行代謝酶、轉運體、分化標記物的表達和活性分析。結果顯示,在蛋白水平和mRNA水平上,根據不同物質處理,ⅰ、ⅱ期酶均有本構性和誘導性表達。因此,在肝臟和皮膚的聯合培養中,多器官芯片是一種有前途的體外方法,用于全身和局部劑量的藥物和化妝品。
6、肺類器官在芯片上的培養(菲莫國際)-空氣環境對呼吸道的影響
使用類人肺模型研究吸入氣溶膠的沉積和吸附,從而使體外人體呼吸毒性的數據更加準確和可預測。目前的體外氣溶膠暴露系統通常不能模擬這些特性,這可能導致在體外生物測試系統中交付非現實的、非人體相關的可吸入試驗物質劑量。模擬和研究體外氣溶膠暴露裝置-吸入器可主動呼吸、操作醫用吸入器,或吸吸煙草制品。此外,它可以填充從人類呼吸道不同區域分離的三維上皮細胞。包括口腔、支氣管和肺泡細胞培養物的氣溶膠傳遞和相容性的概念的研究,將其應用于測試系統,吸入產生的生理條件下,測試表現在人的呼吸道的方式。這種方法的優點是,它無需花費昂貴、耗時和具有科學挑戰性的工作來確定體內提供的劑量,默認情況下,適用于任何測試煙草燃燒產生的氣體和任何測試成分。
此外,通過功能和結構上培養人的呼吸道器官模型,該系統消除了在處理呼吸道不同區域時重復暴露與吸煙環境,并能夠測試任何相關的呼吸模式或行為。由于該系統能夠自行產生或取樣測試氣溶膠,且其方式與人類呼吸道的做法高度相似,因此消除了在外部測試大氣產生或取樣過程中引入實驗人工制品的風險。
通過建立類器官培養和鑒定平臺,培養人肺類器官模型,研究煙草(包括煙霧)燃燒后的氣體對人體內健康的影響,從而領導煙草行業的一場技術變革,以創造一個無害煙的未來,并最終以無害煙產品取代香煙,從而造福于那些原本會繼續吸煙的成年人、社會、公司。