技術文章
單抗與多抗該怎么選擇了解一下?
閱讀:1095 發布時間:2018-11-29抗體是生物學科研工作中有力的工具,沒有之一。這些“制導武器”,會在研究中主動尋找并結合研究者感興趣的目標,并可通過各種示蹤技術將目標展現出來。正是由于抗體的專一特性,研究者可能會依賴于示蹤實驗所顯示的結果對所研靶標給出定性或定量的判斷。也正因此,毫無疑問的,專一性或特異性是抗體科研工作者關注的特性。那么,抗體特異性主要由什么決定?為什么常聽到多抗特異性不如單抗的說法?在實驗中,是該選擇單抗還是多抗?
下面我們將就抗體的生產制備過程分析抗體特異性差異的原因。
- 我們不“生產”抗體,我們只是大自然的“篩選”工
抗體的制備,無論是單抗還是多抗,其前期的動物免疫步驟是*相同的,差異僅僅在篩選。或者說,單抗是在多抗制備的基礎上,進一步篩選并穩定表達特異單克隆細胞株的結果。當抗原免疫動物后,在淋巴結和脾等淋巴器官內通過一系列抗原處理和遞呈,促使B淋巴漿母細胞(Plasmablasts, PBs)分化成熟,在轉錄水平成為分泌特異抗體的B淋巴漿細胞(Plasma cells, PCs),大量不同的漿細胞會分泌不同的針對抗原的抗體。由此,可以說每一個B漿細胞都成為一株單克隆抗體的候選者。
傳統的單克隆抗體制備就是通過將小鼠脾細胞與骨髓瘤細胞系融合,篩選能夠分泌特異抗體并穩定傳代的融合細胞株而實現的。而多克隆抗體(多抗)的制備就是從血清中分離純化所有的未經篩選的單克隆抗體。從以上過程可以看出,無論是單抗還是多抗制備方法,其針對靶點(抗原)的特異性抗體的產生主要源于被免疫動物自身的漿細胞分化成熟,抗體生產者(人)其實并沒有做什么。
不同在于,多克隆抗體猶如許多單克隆抗體的集合,它們有的特異性高,有的特異性低,總體特異性符合正態分布曲線的形式(如Fig1),而其特異性的總體表現也應處于統計學正態曲線中位線(MID)的水平。而單抗制備后續的篩選過程,可去除大部分的非特異抗體,保留幾株特異性較好的單克隆抗體。
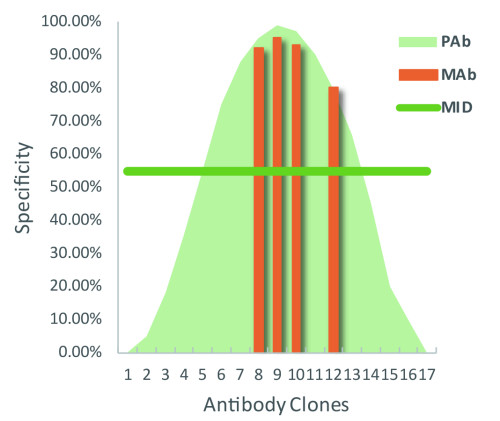
Fig1. 單抗與多抗特異性示意圖
- 傳統雜交瘤法篩選單抗的缺陷
然而,單抗制備過程中的細胞融合是一個隨機發生的過程,動物脾臟內的各種細胞如內皮、平滑肌、巨噬、NK、T、還有紅細胞、血小板等都可能與骨髓瘤細胞系發生融合。盡管B細胞是脾臟內主要的淋巴細胞,但能夠分泌特異性抗體的成熟漿細胞占脾細胞的比例很低,加之促細胞融合試劑如PEG等的細胞毒性,使得終成功融合形成穩定表達特異性抗體的雜交瘤細胞系的效率極低,大約為10-6。因此,在單抗制備過程中,大部分分泌特異性抗體的B細胞可能都被損失了。終獲得的單克隆抗體其親和力和特異性可能都不是本次免疫中的。
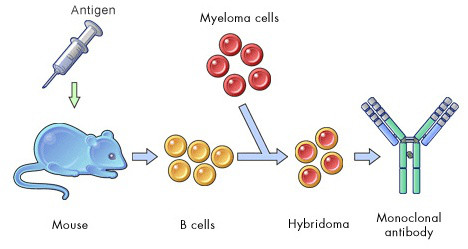
Fig2. 單克隆抗體制備流程
假如把每個漿細胞比作一個士兵,人就是指揮官,指令新兵們訓練打靶。打靶的次數(免疫次數)增多后,會有越來越多的新成神槍手。指揮官將好的神槍手挑出來,培養成一個一個的“手”(單克隆抗體)。然而,手的選拔機制卻是簡單粗暴的,且與能力無關,比如能否舉起200 kg的杠鈴,這可能將真正的手淘汰掉了。而多抗就像一個經過訓練的老兵連隊,既有槍法平庸的兵,同時也擁有的手。
- 為什么應用多抗會產生更多雜帶或更高染色背景?
生物樣本的成分通常非常復雜。雜帶或高背景通常是由于多克隆抗體中有的抗體克隆非特異地結合復雜樣本造成的。如前所述,多抗所表現的特異性是多個抗體克隆的中位線水平。所以從特異性上講,多抗通常不如單抗。多抗特異性可通過生產環節比如使用高純度的免疫原,以及使用提純的靶點蛋白對多抗進行免疫親和層析純化等方法得以改進。經過免疫親和層析的多抗其總體特異性將大大提升,與單抗相比已相差無幾。
另一方面,不同生產廠商制備多抗的原理方法基本相同,然而在抗原設計及制備上千差萬別。如使用全長蛋白,則蛋白的表達純化,如使用多肽,則多肽的位置選擇,不同廠商都有各自的策略,這也使得針對同一靶點的多抗特異性相差較大。在研究者的交流過程中也留下“多抗特異性差”的印象。因而,如果使用多抗檢測,推薦更有經驗、口碑更好的生產廠商。
- 關于特異性的認識誤區
一般而言,單克隆抗體的確具有更高的特異性,但這個特異性是指針對抗原上一個表位(epitope)或抗原決定簇(determinant)的特異性,而不是指針對整個靶點蛋白的特異性。根據抗體核心的表位結合區域—互補決定區(Complementarity Determining Region,CDR)的結構,抗體通常可以緊密結合的抗原表面區域或表位面積很小(<5 nm),對于變性的肽段約在4-8個Aa以內,以及5-7個單糖的糖鏈或6-8個核苷酸的核酸。通過肽段BLAST可以得知,小肽段序列*相同的情況將在很多不同蛋白上發生。這意味著單抗識別的這個表位可能并不僅僅屬于靶標蛋白本身,也即意味著,即使利用純化抗原蛋白進行了特異性篩選的單克隆抗體,當用其檢測復雜樣本時,也將面臨交叉反應或假陽性問題。這仍須以不同的檢測手段比如基因敲除等對結果進一步確認。
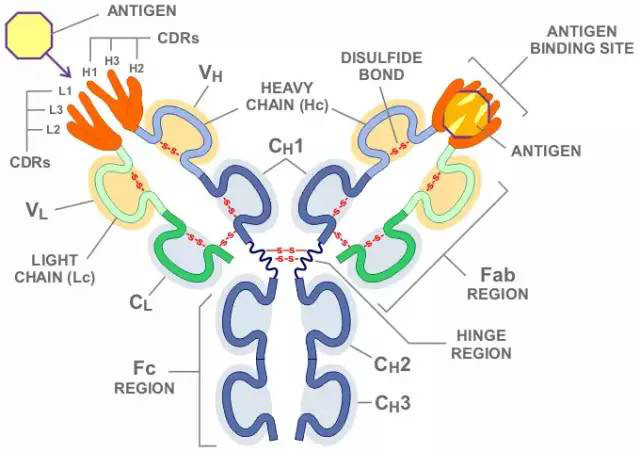
Fig3. IgG分子結構
- 多克隆抗體在敏感性上的優勢
當我們計劃利用抗體去抓出感興趣的靶點時,需要考慮抗體的特異性和敏感性兩個因素。特異性決定了假陽性結果的多少,敏感性決定了檢出率的高低。在復雜樣本中,由于多克隆抗體識別抗原的多個表位,可以在一個抗原分子上結合更多的抗體分子,也可以在當部分抗原表位受到一定程度的遮蓋或破壞時,仍有抗體結合在未受影響的表位上。這種情況常發生在如石蠟包埋的免疫組化(IHC-P)等實驗中,當樣本經甲醛交聯固定后,即使經過抗原修復,抗原表位也不可避免地受到了影響,此時單克隆抗體由于只識別一個表位,結合能力可能大大降低甚至呈現陰性結果,而只要不是所有表位都受到了破壞,多抗仍可以獲得該靶點的陽性結果。同樣的,對于樣本中一些表達豐度極低的蛋白,由于多表位結合更多抗體分子,檢測信號就將被放大,因此,使用多抗具有靈敏度和檢出率上的優勢。
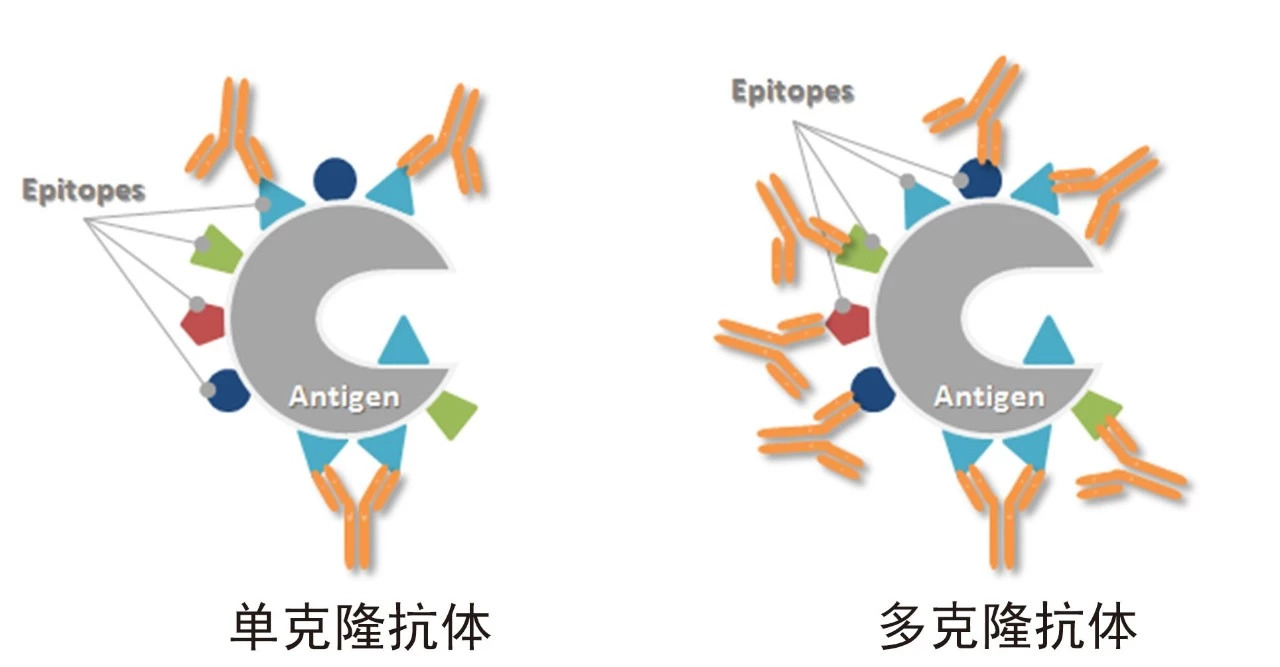
- 特異性與靈敏度的平衡
幾乎所有的生物學檢測指標都需要考慮特異性和靈敏度兩個參數。對于一項檢測,在一定范圍內這兩個參數往往是對立的。更加嚴格的檢測標準或更高的檢測閾值,可以避免假陽性出現,即特異性高;然而過高的標準會造成假陰性升高,即靈敏度低。用戶需要根據實驗需要選擇抗體。相對而言,樣本經過了固定、包埋、變性等預處理,或靶標蛋白本身在樣本中的表達豐度很低,適合使用多克隆抗體檢測。
小結
單克隆與多克隆抗體差異總結
單克隆抗體 | 多克隆抗體 | |
制備周期 | 長(5-6個月) | 短(2-3個月) |
技術要求 | 高 | 低 |
產量 | 高 | 低 |
價格 | 高 | 低 |
對免疫原要求 | 較高 | 高 |
特異性 | 高 | 高(抗原親和純化) |
識別表位 | 一個 | 多個 |
非特異結合 | 較少 | 較多 |
靈敏度 | 較高 | 高 |
標準化 | 易,批間差小 | 較難,批間差大 |
穩定性 | 較好 | 好 |
凝集反應 | 大多數沒有 | 有 |
沉淀反應 | 大多數沒有 | 有 |
中和活性 | 大多數沒有 | 有 |
為減少多克隆抗體制備中的批間差,生產環節需要更加嚴格控制,每批次免疫動物的數量至少三只,以降低動物個體差異影響。動物的來源、種系、性別、周齡、體重、飼喂環境、免疫原及免疫流程(SOP)等也嚴格保持一致,這樣可以有效控制多抗生產時的批間差。
總之,在不同實驗中善用“手”和“老兵連隊”,可以更加地獲得所需的實驗結果。
 化工儀器網
化工儀器網