技術文章
PKA-G9a 對胚胎干細胞早期分化的調控作用
閱讀:685 發布時間:2018-9-27胚胎的形成是一個機體高度協調配合的過程,其分化過程被嚴格控制,但具體的調控機制尚不清楚。胚胎干細胞是分離自著床前胚胎內細胞團的細胞系,在體外特定條件下可長期培養,具有分化性,是體外研究細胞分化過程的合適選擇。
環磷酸腺苷 (cAMP, cyclic adenosine monophosphate)-環磷酸腺苷依賴的蛋白激酶 A(PKA, protein kinase A) 信號通路分布于多種細胞中,可以調節細胞的增殖和分化 (如骨髓間充質干細胞、牙髓干細胞等)。cAMP 為經典的信號通路是通過激活 PKA 實現對細胞功能的調控,細胞受到外界刺激時如受到腎 上腺素刺激時,細胞內 cAMP 濃度上升,隨后細胞內四分子的 cAMP 分別與 PKA 的兩個調節亞基結合。PKA 結合 cAMP 后,其調節亞基和催化亞基解離,游離的兩個催化亞基進入細胞核內作用于下游信號分子如 CREB 等,參與目的基因的轉錄,從而發揮其對細胞增殖、分化與凋亡等的調節作用。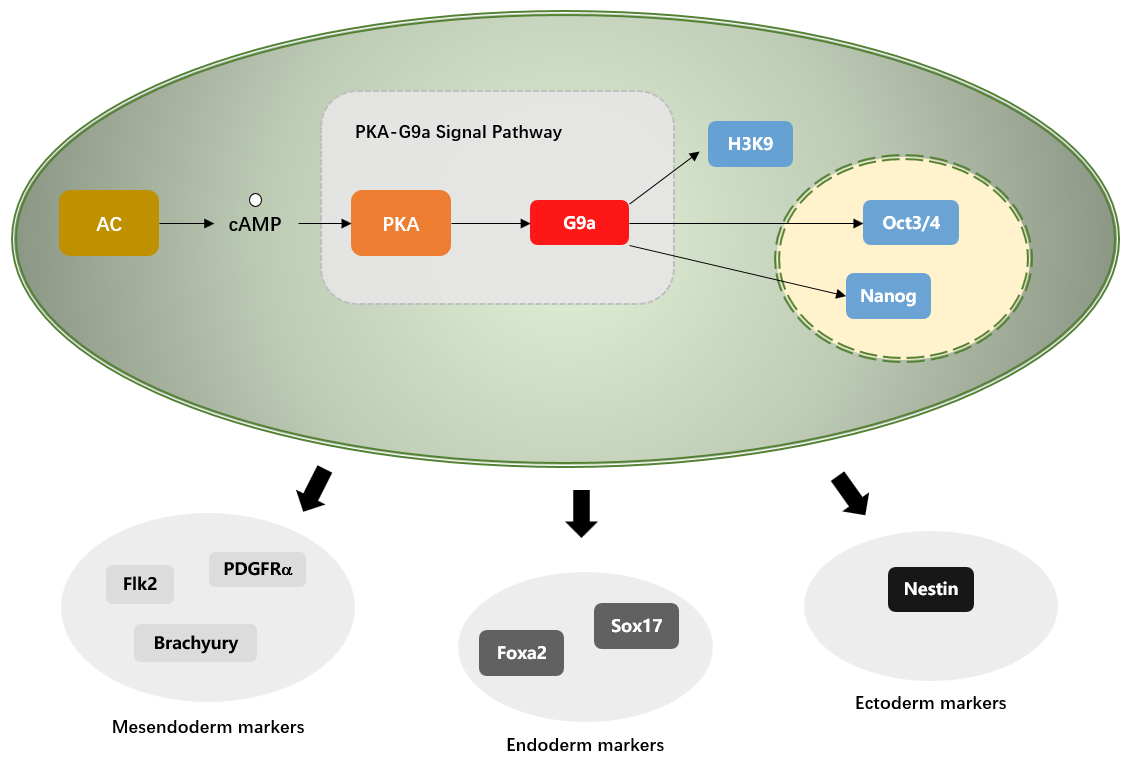
cAMP-PKA 信號通路在細胞脅迫、再生過程中具有重要作用。本文通過對胚胎細胞早期分化標志物的檢測,研究了 PKA 激活及下游的 G9a(EHMT2)甲基化酶在胚胎細胞早期分化過程中的重要調節作用。
本研究中檢測內胚層和外胚層標志物 Foxa2 和 Nestin 的抗體來自 Bioss(Anti-Foxa2, bs-2358R;Anti-Nestin, bs-008R)。
日本京都大學干細胞分化團隊 Kohei Yamamizu 等以 PKA 為著手點,利用小鼠胚胎干細胞(ESCs)為模型,分析了 cAMP/PKA 信號通路對胚胎干細胞分化的作用及相關信號傳導機制。首先,證明了胞內 cAMP 濃度的升高是促使 ESCs 分化的必須條件(Fig1A),通過檢測發現 CA-PKA 細胞模型(DoX-,PKA 激活模型,Fig1B)在 D1.5 即有 FlK+ 、PDGFRα+中胚層細胞和 Brachyury+中內胚層細胞生成,與此同時 SSEA1+(未分化 ESCs 標志)細胞比例卻明顯下降(Fig1C-I),由此可知 PKA 可以在 ESC 分化早期促使 ESC 向中胚層細胞轉變。
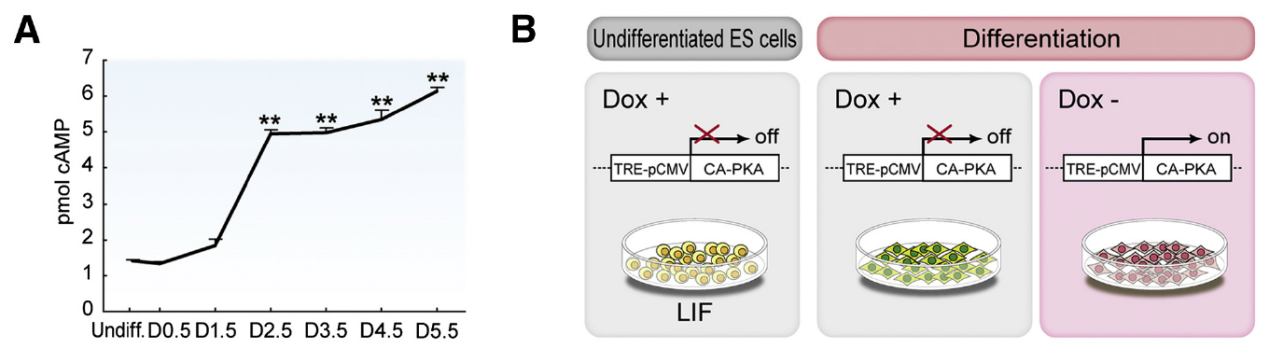
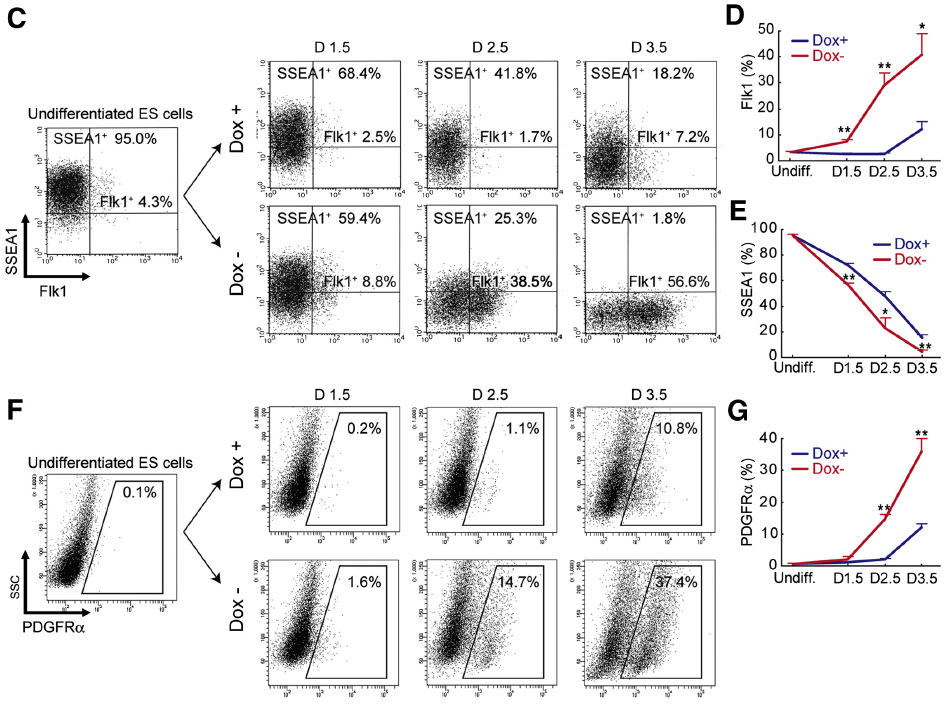
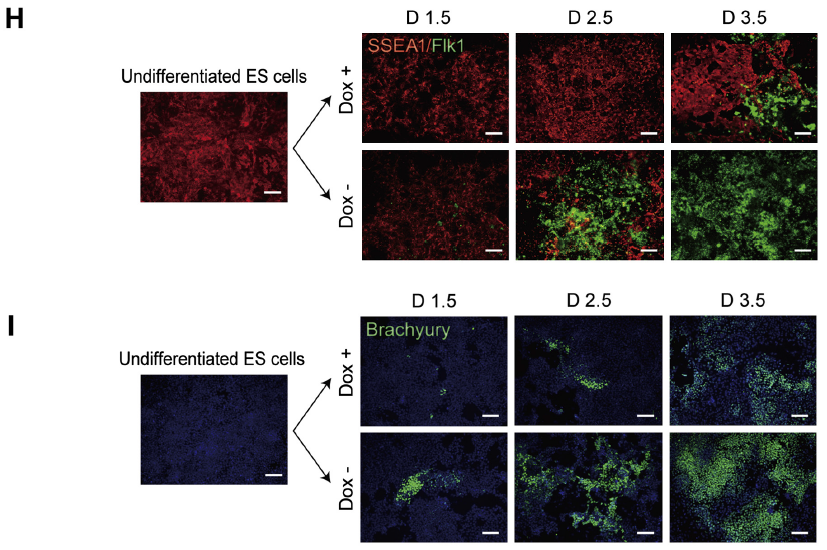
Fig 1. PKA Accelerates Differentiation Timing of Mesodermal Cells from ESCs
在 PKA 激活狀態下,內胚層標志細胞 Foxa2+(Anti-Foxa2, bs-2358R, Bioss)和 Sox17+在 D1.5 出現,在隨后的 2 天中持續增多(Fig2A-D);外胚層標記細胞 Nestin+(Anti-Nestin, bs-008R, Bioss)所占比例也自 D1.5 開始呈直線上升趨勢(Fig2 G-I)。綜上可知,PKA 可以加速小鼠 ESCs 向三胚層細胞的分化。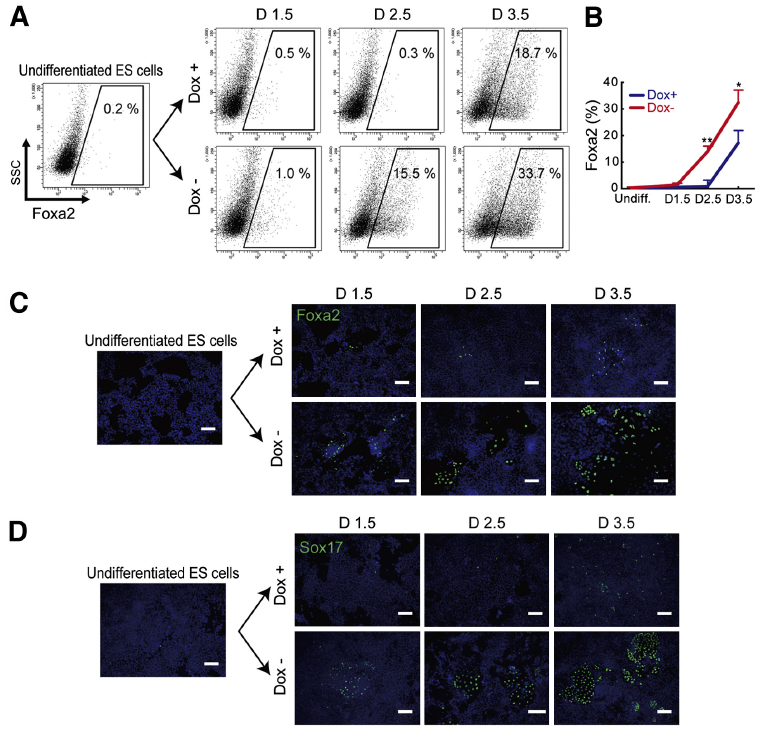
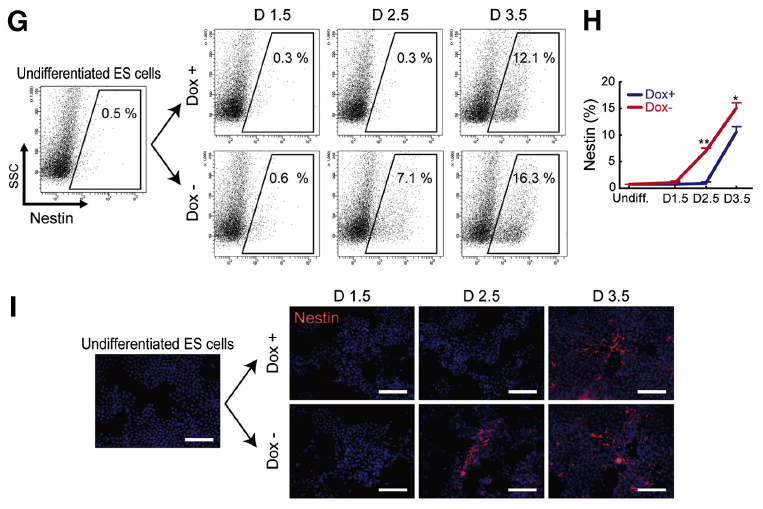
Fig 2. PKA Accelerates Differentiation Timing of Endodermaland Ectodermal Cells from ESCs
在 ESCs 分化過程中,PKA 與多種基因表達有關,據此推測 PKA 下游信號通路可能會涉及到基因的遺傳性修飾。表觀遺傳因素在細胞型和分化相關基因表達的調控中起著重要作用,其中組蛋白甲基化和 DNA 甲基化是表觀遺傳學的主要機制,參與了異染色質形成、基因印記、基因的轉錄調控等過程。在本研究中 H3K9me2 在眾多組蛋白 H3 甲基化蛋白中表達水平明顯增多(Fig3A)。
G9a 是一種具有經典 SET 結構域的組蛋白甲基化轉移酶,主要負責常染色質區域組蛋白 H3 中 K9 位點的甲基化,可以促進基因啟動子區域組蛋白或 DNA 的甲基化,從而抑制基因轉錄,其在哺乳動物的胚胎發育和細胞分化過程中起著*的作用。本研究中發現在 PKA 激活狀態下,G9a 蛋白表達水平在細胞分化早期就明顯增多,且表達增多節點先于 H3K9me2(Fig3B-C)。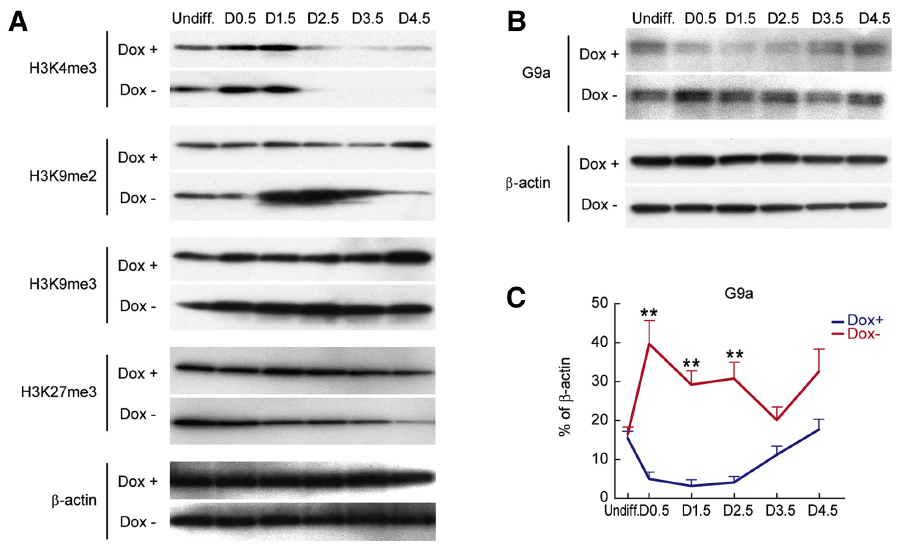
Fig 3. PKA Regulates G9a Expression Accompanied by H3K9me2 and DNA Methylation in Early Differentiation from ESCs
ESCs 細胞型主要由復雜的轉錄因子網絡調控,其中 Oct3/4 和 nanog 是調控型的核心因子,它們的表達變化都會引起細胞分化。在隨后的研究中發現在 Oct3/4 和 nanog 的啟動子區域 H3K9 的二甲基化比例有所提高,同時 Oct3/4 和 nanog 的啟動子區域 DNA 甲基化程度也顯著提高。
為進一步確定 PKA 在細胞早期分化的調控作用是由 G9a 所介導,建立了 CA-PKA(Dox-)-G9a-ckO(OHT+)細胞模型(Fig4A-B)。研究結果表明,當 G9a 表達被抑制后,在 PKA 激活狀態下優勢表達的陽性分化細胞及相關基因啟動區的遺傳修飾均被消除(Fig4C-M)。后續研究發現 G9a 敲除小鼠胚胎也有類似表達,即更加充分證明了 PKA 和 G9a 共同調控胚胎(干細胞)的早期分化。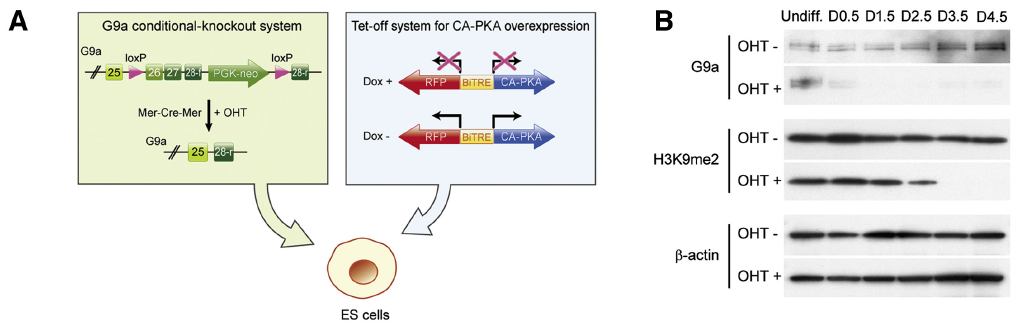
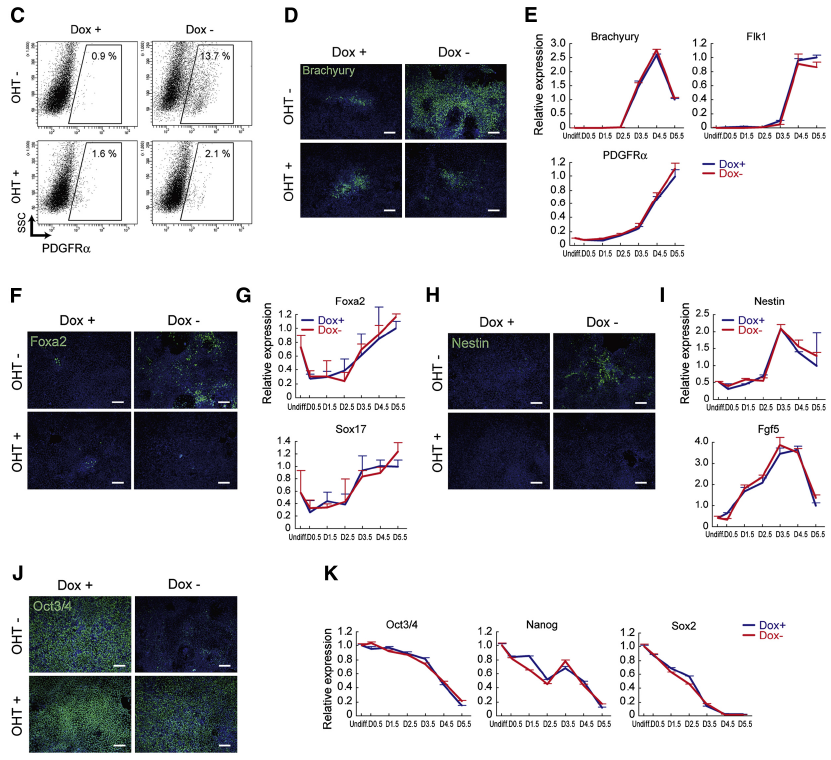
Fig 4. Effects of PKA on Early Differentiation Are Dependent on G9a
本研究為我們展示了基于 PKA 和 G9a 共同調控胚胎干細胞分化速度的分子機制(Fig5),有助于我們了解胚胎干細胞(ESC)維持自我更新及多向分化潛能的具體機制,有助于未來更好地將其應用于再生醫學研究領域。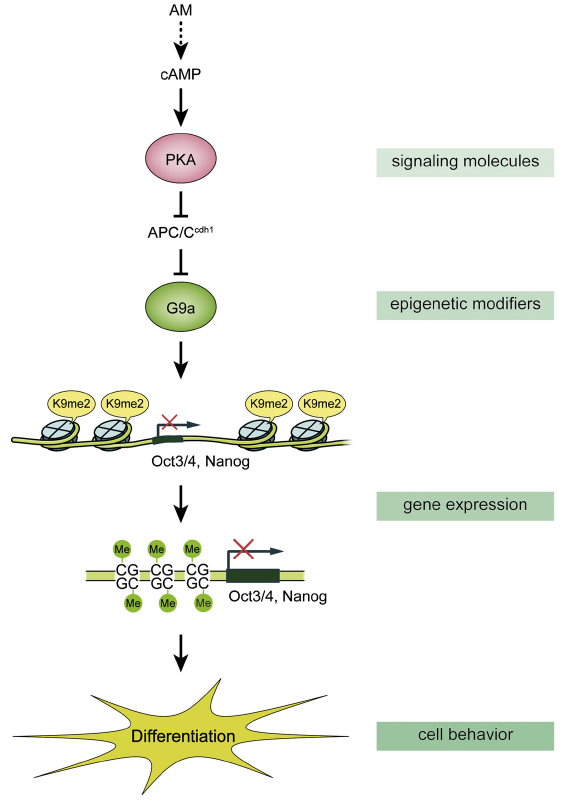
Fig 5. Molecular Linkages Regulating Differentiation Timing in Early ESC Differentiation and Embryogenesis
 化工儀器網
化工儀器網