巴氏吸管由醫用級聚乙烯(PE)制成,管體
Cell:可視化觀察流感病毒入侵靶細胞過程
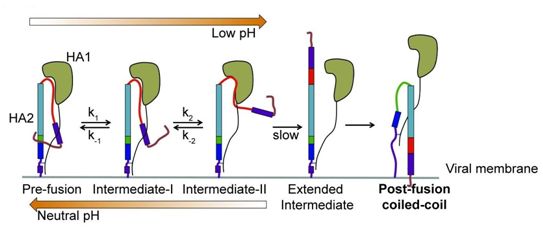
在一項新的研究中,來自美國塔夫茨大學醫學院、西奈山伊坎醫學院、德國圖賓根大學和美因茨大學的研究人員直接地可視化觀察流感病毒的表面蛋白發生的實時結構變化,這些變化可能有助這種病毒與靶細胞融合,入侵它們的內部并劫持它們的功能。他們發現位于流感病毒表面上的單個血凝素(hemagglutinin, HA)分子解折疊并向靶細胞延伸,隨后重新折疊,這個過程每秒會發生5至10次。這一發現表明流感病毒要比之前認為的發生更大的動態變化,這可能有助于開發更加有效的疫苗和更好地理解埃博拉病毒、HIV和非典型肺炎冠狀病毒(SARS-CoV)等其他的病毒。相關研究結果于2018年6月28日在線發表在Cell期刊上,論文標題為“Direct Visualization of the Conformational Dynamics of Single Influenza Hemagglutinin Trimers”。論文通信作者為塔夫茨大學醫學院的James Munro博士和Dibyendu Kumar Das博士。
圖片來自James Munro, Tufts University School of Medicine。
幾十年來,流感病毒一直是通過一種相同的機制入侵細胞的一大類病毒的研究模型:這些病毒表面上的包膜蛋白必須將它們附著到細胞膜上,隨后它們與細胞融合在一起。這種融合讓病毒的內含物釋放到細胞中,因此它就能夠接管細胞的內部功能并進行增殖。流感病毒的包膜蛋白HA長期以來一直是研究其他病毒中的融合機制的模板。
Munro說,“包膜蛋白被描述成老式的捕鼠器,處于靜態的彈簧加壓狀態,等待著與靶細胞發生相互作用的觸發。一旦受到觸發,它們在三維結構上就會經歷巨大的變化,從而使得流感病毒與細胞發生融合并入侵靶細胞內部。然而,盡管之前的研究已給出一些提示,但是這個過程并未直接被人們觀察到,而且人們廣泛地認為這種病毒表面上的每個包膜蛋白分子經觸發后僅有一次機會附著到靶細胞表面上。”
通過使用先進的成像技術---用于測量經過熒光染料標記的單個分子內的納米距離的單分子熒光共振能量轉移(single-molecule Förster resonance energy transfer, smFRET),隨后對獲得的數據進行重要的計算分析,這些研究人員對尋找細胞靶標的單個HA分子的形狀變化進行實時可視化觀察。為了便于開展這些實驗,對HA分子的成像是在它們位于一種與流感病毒不存在親緣關系的病毒的表面上開展的。
這些研究人員發現的是一種多功能且發生動態變化的HA分子,這與之前假設的模型相差甚遠。Munro說,“這種病毒分子能夠自我重構,然后逆轉這種自我重構,并多次快速地重復這個過程。這個事實改變了我們看待病毒入侵的方式。”
這種可逆性可能以多種方式讓流感病毒受益,包括在沒有合適靶標存在的情況下阻止過早激活,讓眾多病毒分子能夠保持同步以便增強入侵效率,并干擾細胞中的識別病毒的形狀來抵抗它入侵的保護性抗體。
Munro說,“表面蛋白是免疫系統‘觀察到’的這種病毒中的唯yi部分。因此,幾乎所有已知抑制病毒增殖的抗體都靶向這些蛋白。我們問道,‘免疫系統識別什么結構才能制造出更加有效的抗體?’”
還需開展進一步的研究來證實這種蛋白動態變化是否也存在于流感病毒之外的其他病毒中,而且利用惰性的沒有感染性的埃博拉病毒顆粒進行的可視化觀察實驗正在Munro實驗室中開展。(生物谷 )
參考資料:
Dibyendu Kumar Das, Ramesh Govindan, Ivana Niki?-Spiegel, et al. Direct Visualization of the Conformational Dynamics of Single Influenza Hemagglutinin Trimers. Cell, Published online: 28 Jun 2018, doi:10.1016/j.cell.2018.05.050
 您好, 歡迎來到化工儀器網
您好, 歡迎來到化工儀器網

 12
12


